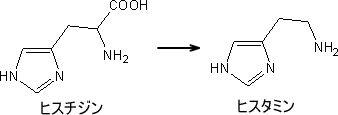
工学系のための生化学 左右田健次, 谷澤克行, 今中忠行 2012年発行
●谷澤 克行(たにざわ かつゆき)
1948年大阪府に生まれる。1977年京都大学大学院農学研究科博士課程修了。現在、大阪大学産業科学研究所教授。専門は酵素科学(生化学、構造生物学)。農学博士。
http://www.amazon.co.jp/%E5%B7%A5%E5%AD%A6%E7%B3%BB%E3%81%AE%E3%81%9F%E3%82%81%E3%81%AE%E7%94%9F%E5%8C%96%E5%AD%A6-%E5%B7%A6%E5%8F%B3%E7%94%B0-%E5%81%A5%E6%AC%A1/dp/4759814647
ビルトイン補酵素 谷澤克行
最近,さまざまな酵素中に新しい補酵素が相ついで発見されている。これらはいずれも 酵素蛋白質のポリペプチド鎖にアミノ酸残基誘導体として結合しており,ビルトイン補 酵素とよばれている。
http://lifesciencedb.jp/dbsearch/Literature/get_pne_cgpdf.php?year=1999&number=4413&file=pEFW1uSbwW9zVnIJBZvfLQ==
『酵素のちから―生命を支える』 左右田健次/著 岩波ジュニア新書 2005年発行
(コラム) 自分を変える酵素 (一部抜粋しています)
自分で自分の性格を変えることは容易ではありません。しかし、酵素の中には、自分を改造する酵素があります。
1960年代当時、アメリカ、カリフォルニア大学のE・スネルの研究室は、アミノ酸代謝において重要なピリドキサル酵素の研究の世界的中心でした。ここで、画期的な研究がおこなわれたので、紹介しましょう。
乳酸菌のヒスチジンデカルボキシラーゼは、ヒスチジンと二酸化炭素に分解することに作用する酵素です。これが、アミノ酸デカルボキシラーゼの1つであるのに、補酵素ピリドキサルリンさんを含まず、その代わりにピルビン酸がペプチド鎖の構成成分として、活性中心に存在することが証明されました。アミノ酸だけからできているはずのタンパク質の中に、アミノ酸ではなく、ケト酸の1つ、ピルビン酸が含まれることは例外中の例外です。
さらに、この酵素はまず、不活性な酵素としてつくられます。つぎに、この酵素自体が触媒となって、自分のN末端のペプチド部分にあるセリン残基(-Ser-)とセリン残基の間の結合を切ります。N末端側のペプチド部分はセリン残基がC末端となる小さなペプチドとなります。もう1つのセリン残基はピルビン酸残基に変り、ピルビルフェニアルアラニン残基を端にもつ長いペプチドが生成します。これが活性型の酵素です。
この酵素は自分の力で、自分のからだを不活性型から活性型に変えるのです。さらに、このようにしてできたペプチド部分が触媒作用において中心的な役割、つまり補酵素のピリドキサルリン酸と本質的には同じ働きをするのです。しかし、興味深いこの研究もただ1つの例外として、いつしか忘れ去られていました。
その後、30年ほどたった1990年代になって、アメリカ・カリフォルニア大学の女性化学者J・クリンマンは、アミン・オキシダーゼの活性中心にペプチドに結合しているトバキノン(TPQ)が存在する事実を証明しました。トバキノン残基ははじめ、不活性なチロシン残基としてつくられ、その後、酸素と銅イオンの助けをかりて、自分の触媒の力でトバキノンに変えるのです。この仕組みは大阪大学の谷澤克行によって明らかにされ、このような酵素の活性中心のペプチドに組み込まれている触媒基を「ビルトイン補酵素」と命名しました。その後、いろいろなビルトイン補酵素が発見されました。
これらは、さきのピルビン酸残基とともに、ふつうの補酵素と大きくちがいますから、補酵素の定義を変えなければいけないほどの発見でした。また、これらのビルトイン補酵素はどれも最初は不活性なタンパク質としてつくられ、ついで、酵素は自分自身の触媒作用によって活性型のビルトイン補酵素に改造します。スネルらの研究はこれらの一連の研究の先駆けであったことが、30年後に認められたのです。