じじぃの「カオス・地球_212_免疫超入門・第6章・免疫チェックポイント受容体(PD-1)」
肺がんの最新治療③分子標的治療と免疫チェックポイント阻害薬
動画 YouTube
https://www.youtube.com/watch?app=desktop&v=bL_hAsSow0o
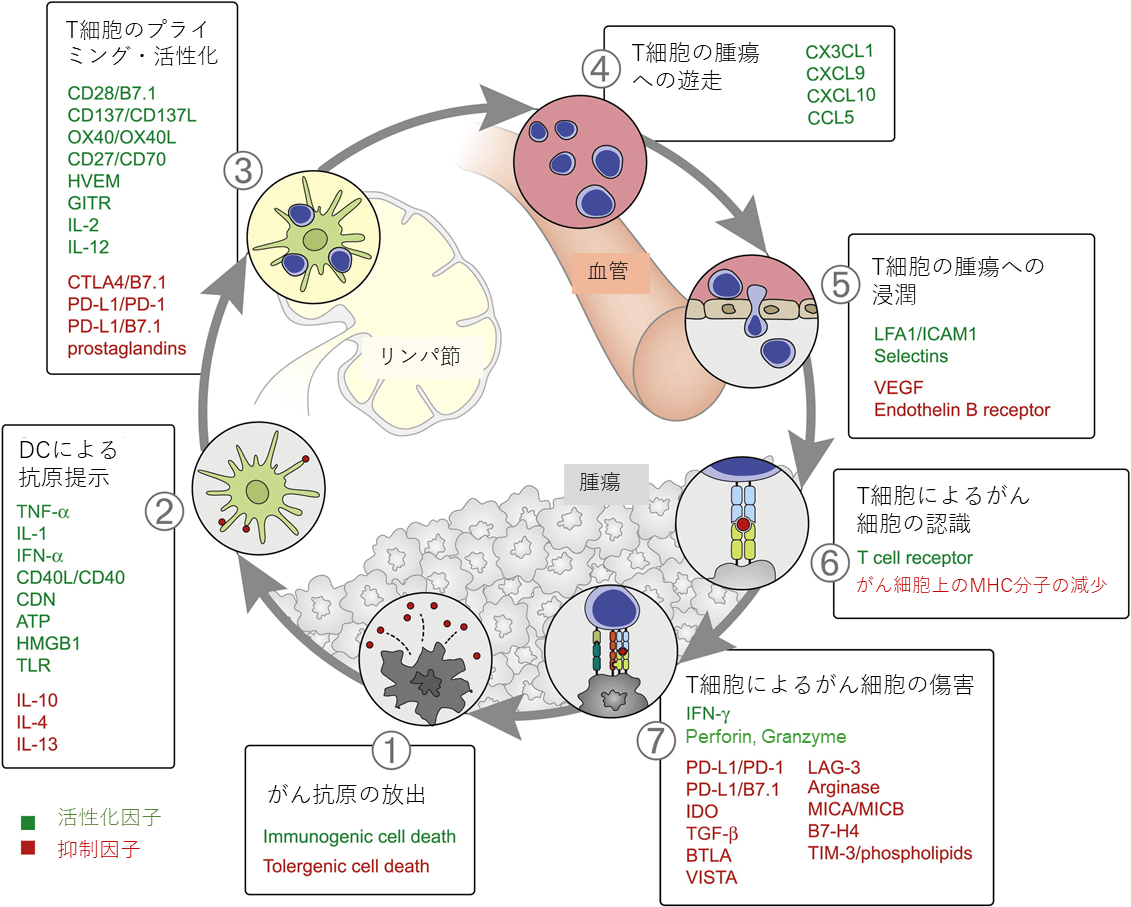
図 抗腫瘍免疫によるがん治療
がん免疫サイクル
慶應大学 吉村研究室 - 抗体療法
●現代免疫学の金字塔:抗体療法
(2) 抗腫瘍免疫によるがん治療:免疫のブレーキをはずせ!
癌に対する『免疫チェックポイント阻害療法』はつい最近はやりだした言葉である。2015年にラスカー賞を受賞したアリソン教授はT細胞免疫のブレーキであるCTLA4を発見した。
彼のグループはマウスを使ってCTLA4を中和することでT細胞の活性が強まり、抗腫瘍免疫(癌細胞を異物として攻撃する免疫)が増強されることを示して来た。そして2010年にはヒト型CTLA4モノクローナル抗体(イピリムマブ)が実際にヒトの悪性黒色腫(メラノーマ)に対して強力な効果を示し、約2割の患者で癌が消滅したことが報告された。
続いて、もうひとつのブレーキであるPD-L1やその受容体のPD1に対する中和抗体もメラノーマや腎臓がんなどに効果があることが報告された。PD1は京都大学の本庶佑先生らが発見したもので、その抗体は小野薬品が開発したニボルマブである。CTLA4やPD1は免疫のブレーキ(チェックポイント)であることからこのような免疫を抑制するシグナルを抑制する治療法を『チェックポイント阻害療法』と呼ぶようになった。これもNHKで取り上げられるなど大いに脚光を浴びている。
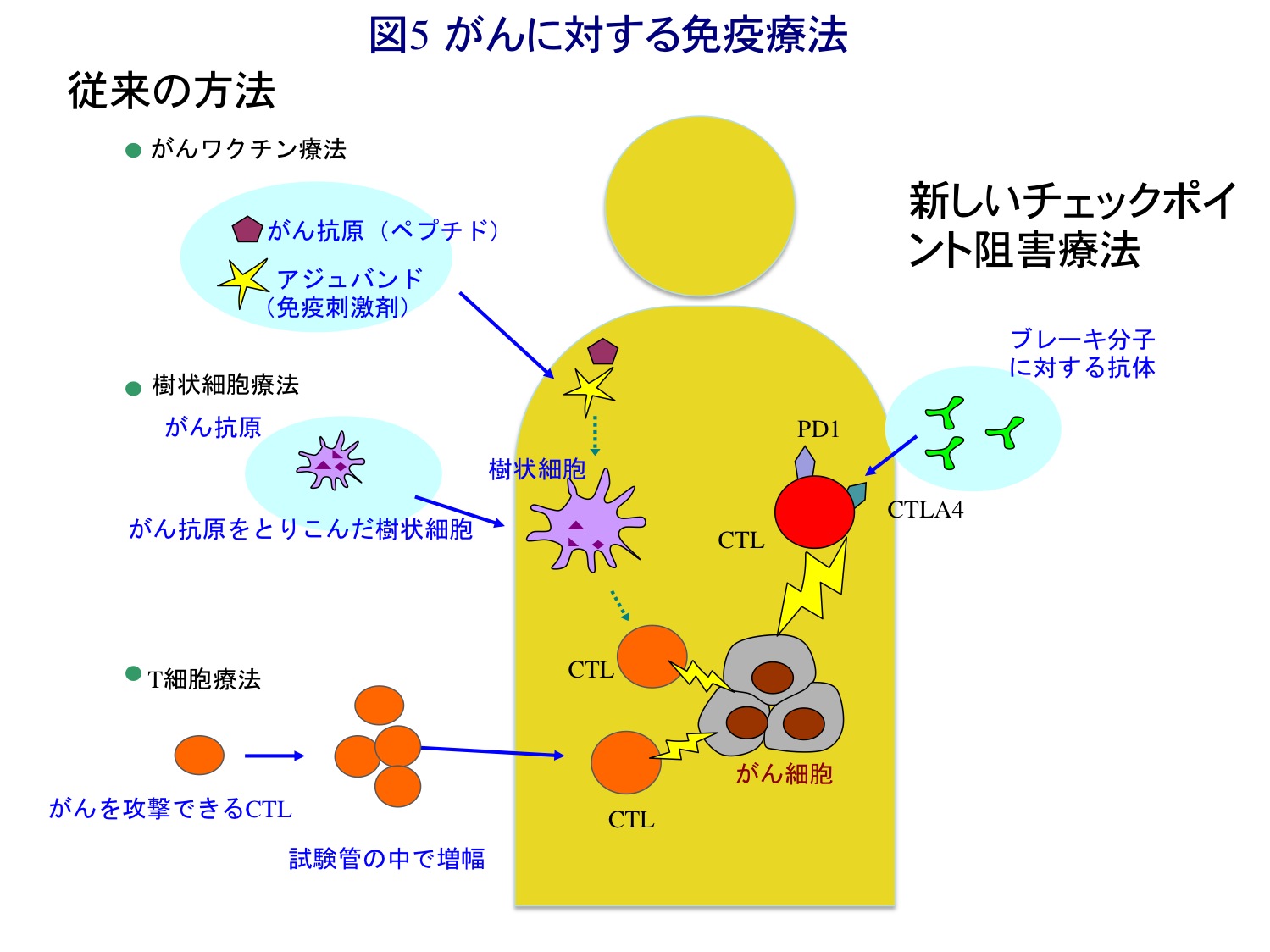
実は『癌の免疫療法』は古くから試みられて来た。腫瘍内のT細胞を増やして体内に戻す方法や、腫瘍抗原のペプチドや樹状細胞で免疫する方法である(図5左)。
http://new2.immunoreg.jp/modules/pico_kennai/index.php?content_id=13
制御性T細胞(Treg)
東京CAクリニック より
制御性T細胞は、FOXP3という転写因子を活性化することでCTLA-4という分子とIL-2受容体を常に細胞表面にたくさん出しています。
CTLA-4は免疫を抑制する分子で、ヘルパーTリンパ球やキラーTリンパ球が樹状細胞から刺激されるのを邪魔します。したがって、このCTLA-4に蓋をしてしまえば免疫反応を抑制しようとする邪魔者がいなくなるので、がん治療にとっては好都合です。世界初の免疫チェックポイント抗体であるヤーボイ(Yervoy)は、このCTLA-4を阻害する薬剤として開発されたものです。
-
-
-
-
-
-
-
-
-
- -
-
-
-
-
-
-
-
-
免疫「超」入門 「がん」「老化」「脳」のカギも握る、すごいシステム
【目次】
第1章 人類の宿命・病原体と免疫の戦い
第2章 ヒトに備わった、5つの感染防御機構
第3章 病原体との攻防
第4章 自己を攻撃する免疫――アレルギーはなぜ起こるのか
第5章 炎症とサイトカイン――さまざまな病気と免疫
第6章 免疫とがん
第7章 老化を免疫で止められるか
第8章 脳と免疫の深い関係
-
-
-
-
-
-
-
-
-
- -
-
-
-
-
-
-
-
-
免疫「超」入門 「がん」「老化」「脳」のカギも握る、すごいシステム
パンデミックによって感染症や免疫に関する情報を目にすることが多くなり、私たちの知識も増えたように見える。ただ、そこで出てきた情報は、曖昧なものや誤った情報、感情的なものなどもあり、玉石混淆ともいえる。
本書ではあらためて、ウイルスなどの病原体がどのように感染を起こし、免疫がどのように働くのか、その複雑なしくみを、基本から正しくわかりやすく解説する。
第6章 免疫とがん より
逆転の発想 免疫のブレーキを外せ
がんに対する「免疫チェックポイント阻害療法」はわりと最近、知られるようになった言葉ですが、何よりも2018年に本庶佑博士とアメリカのジェームズ・アリソン博士がノーベル生理学・医学賞を受賞したことで、一躍脚光を浴びました。
アリソン博士らは、T細胞性免疫のブレーキであるCTLA4に注目しました。第4章で述べたように、CTLA4はCD80/86を物理的に阻害することで免疫寛容を成立させる重要な分子です。彼のグループはまずマウスを使って、CTLA4を中和する(機能を阻害する)抗体を投与すると、がんが退縮することを発見しました。
免疫でがんを治療しようという試みは、古くから行われていました。がん組織内のT細胞を増やして体内に戻す方法や、がん抗原(がん細胞で産生されるがん細胞に特異的なタンパク質)のペプチドをワクチンとして用いる方法や、がん抗原ペプチドを添加した樹状細胞を注入する方法などです。
モデルマウスでは画期的に効く方法もありました。しかしヒトの臨床では効く患者もたまにいるが、効果のない患者も多く、「がんを免疫で治すのは無理」というのが、大方の免疫学者の考えでした。ところが2010年にアリソン博士らの研究成果をもとに開発された抗CTLA4抗体(イピリムマブ)が、実際にヒトの悪性黒色腫(メラノーマ)に対して強力な効果を示し、約2割の患者でがんが消滅したことが報告されたのです。
続いて、もう1つのT細胞性免疫のブレーキであるPD-1に対する中和抗体も、メラノーマや腎臓がん、肺がんなどに効果があることが報告されました。PD-1は本庶博士らが発見した分子で、その抗体が、小野薬品向上が開発した二ボルマブ(商品名オプジーボ)です。PD-1は、T細胞を活性化する第1のアクセルであるT細胞抗原受容体(TCR)のシグナルを阻害します。
これまでのがんの免疫療法は、免疫のアクセルばかり強く踏んでいたのでした。ブレーキの多くは「負のフィードバック」として出てくるもので、アクセルを踏めば踏むほどブレーキも強くなるのです。抗CTLA4抗体や抗PD-1抗体はブレーキを弱める方法であり、まさに逆転の発想だったわけです。
抗CTLA4抗体や抗PD-1抗体の成功は、「免疫には、がんをやっつける能力が備わっている」ことを明確に示し、私たちのがん治療に対する認識を一変させました。この意義は極めて大きく、本庶博士とアリソン博士にノーベル生理学・医学賞が授与されたのも当然のことと思います。
CTLA4やPD-1は、「免疫チェックポイント分子」と呼ばれています。チェックポイントとは、もともと細胞増殖の研究分野で使われている用語です。通常の細胞分裂は、G1期、S期、G2期、M期などと呼ばれる決まった周期を経て進行します。そのとき、栄養や増殖因子が存在するか? DNA浮く製は完了したか? 染色体分離の準備は完了したか? などいくつかのチェックポイントを乗り越えなければ、先にすすめないようになっています。つまりチェックポイントには「細胞周期を監視して止める」という意味があるのです。
PD-1やCTLA4がちょうとT細胞の活性化を止めているように見えることから「免疫チェックポイント」と呼ばれ、それを阻害する抗体などを「免疫チェックポイント阻害剤」と呼ぶようになったと考えられます。ただし厳密な意味では、PD-1やCTLA4はT細胞の活性化に許可を与えているわけではないので、チェックポイントと呼ぶには無理があるように思えます。
ブレーキを外してアクセル全開にしたら?
ところで、抗PD-1抗体とCTLA4抗体の阻害作用は同じなのでしょうか? どちらもキラーT細胞を増やすので、作用点が同じように思えます。ところが、同時に使うと相乗効果があることがわかっています。つまり、抗PD-1抗体とCTLA4抗体は、厳密には作用点が異なると考えられます。
4章の図で示したTreg細胞の免疫抑制メカニズムを思い出していただくと、CTLA4はTreg細胞で常に強く発現していることがわかります。また、がん細胞にはTreg細胞がたくさんあります。これがキラーT細胞の作用を抑えてしまっていることは、容易に想像がつきます。実は、抗CTLA4抗体は、キラーT細胞を増やす作用よりもTreg細胞の作用を阻害する効果の方が強いのではないかと考えられます。
だとすれば、疲弊化に関するブレーキ分子をすべて阻害すれば、アクセル全開になって非常に強力にがんを攻撃できそうです。確かに抗PD-1抗体と抗Lag3抗体の併用は抗PD-1抵抗単独よりも効果が高いとして、アメリカでは悪性黒色腫の治療薬として承認されました。日本でも抗PD-1抗体と抗CTLA4抗体の併用が肺がんで試されました。しかし、死亡例が相次いだことから試験が中止になりました。
ブレーキを外し過ぎると、免疫は暴走してサイトカインストームや自己免疫疾患などを起こしてしまいます。また現在の免疫チェックポイント阻害療法では、がんを攻撃するT細胞と普通のT細胞を区別することもできません。すべてのT細胞でブレーキを外してしまうと、免疫寛容の仕組みが破綻してしまいます。このあたりのさじ加減が難しいところです。