じじぃの「歴史・思想_225_人工培養された脳・人工多能性幹細胞(iPS細胞)2」
秋にもiPS脊髄治療開始 慶応大、負傷間もない患者に
動画 YouTube
https://www.youtube.com/watch?v=AzJjR4T3T74&feature=emb_title
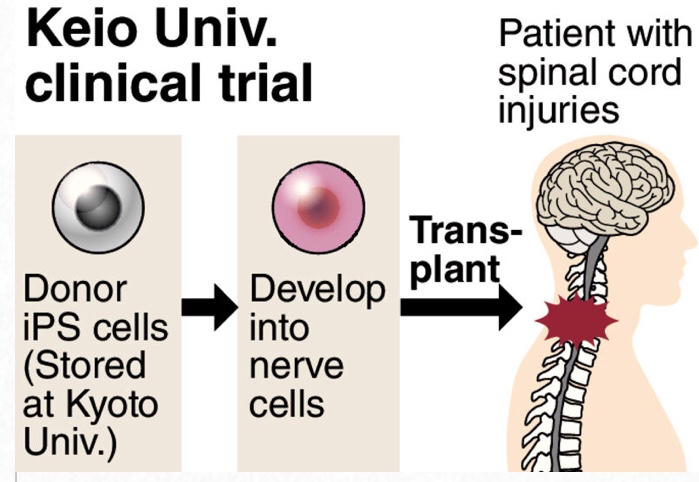
Japan OK’s iPS cell trial for treatment of spinal injuries
FEBRUARY 21, 2019 Barrier Free Japan
The Health, Labor and Welfare Ministry’s assessment committee on regenerative medicine approved Monday a clinical trial by Keio University’s team to transplant human induced pluripotent stem (iPS) cells into patients with spinal cord injuries.
https://barrierfreejapan.com/2019/02/21/japan-oks-ips-cell-trial-for-treatment-of-spinal-injuries/
『人工培養された脳は「誰」なのか』
フィリップ・ボール/著、桐谷知未/訳 原書房 2020年発行
運命の思わぬ展開――細胞を再プログラムするには より
思いも寄らない発想は、思いも寄らない人材によって追究されることが多い。日本の生物学者、山中伸弥はそういう人材のひとりだった。山中は異例な未知をたどって細胞生物学の世界へ入ったので、他の科学者なら頭から退けるような疑問をいだく傾向があった。
熱心なラクビ―選手だった山中は、当然のように、スポーツ障害に興味を持っていた。しかし、1980年代に外科医として訓練を受けたものの、あまり得意ではないことがわかった(ラクビ―ではなく手術が)。1989年、山中は大阪市立大学医学部に入学し、基礎医学研究の博士号を取得した。そして動脈の詰まりが原因で起こる心臓病と、遺伝子治療の可能性を研究し始めた。やがて山中は、腫瘍増殖に影響する遺伝子を研究するようになり、その過程でマウスの胚性幹細胞を利用し始めた。そして自分が研究している腫瘍抑制遺伝子が、マウスのES細胞を多能性状態に保つのに重要なものらしいことを発見した。
山中は、ヒト胚への依存のせいで、日本ではヒト幹細胞の研究がきびしく規制されていることに苛立っていた。胚なしで幹細胞をつくれないだろうか、と山中は考えた。もし幹細胞の多能性を担っている遺伝子を、成熟した体細胞のなかで活性化できたなら、幹細胞のような状態をつくれるのではないか? 山中は、関連する遺伝子の新たなコピーを体細胞に挿入するという単純な方法で、試してみることにした。
遺伝子治療研究のおかげで、細胞に新たな遺伝子を加える一連の方法はすでにあった。遺伝子治療の目的は、正常に機能する遺伝子のコピーを患者の細胞に注入して、患者のゲノムの病因となる変異した遺伝子を壊滅させることだ。細胞に新しい遺伝子を入れる最良の方法のひとつでは、ウイルスを運搬体として使う。
・
もし皿のなかで培養したニューロンを、脊髄損傷、あるいはハンチントン病やパーキンソン病などの神経変性疾患や脳卒中が原因の脳損傷を修復するのに使えるなら、すばらしいことだ。しかし、まずは、ニューロンと他の細胞の正しい混合が必要になる。脳には何百種類もの異なるニューロンがあり、それぞれが独特の形状と接続性のパターンと機能をもっている。しかも、それらのニューロンは、既存のネットワークと適切に連結しなくてはならない。脳の外で正しい組み合わせのニューロンを培養してから、適切な連結ができるようなんらかの方法で移植手術をするのは、かなり困難だろう(後述のように、試みられているが)。しかし、もしニューロンが元の位置で増やせるなら、周囲の組織から信号を受けられ、正しい細胞型へ導かれて、互いにつながり、神経パルスの送受信ができるかもしれない。
そういう事例の選択肢として、iPS細胞(またはES細胞)を直接体内に導入し、周囲の環境が必要な運命に導いてくれるのを待つ方法がある。しかし、重要な疑問――誰も答えを知らないし、あらゆる細胞型と組織型に適用される答えはないかもしれない――は、生体組織が、最初に形成されたときそこにあった幹細胞のための誘導信号をふたたび出してくれるかということだ。そういう信号がまだ活発に働いている、あるいは復活できる保証はない。
それでも、試すことはできる。これまでに、細胞培養したiPS細胞を移植する方法や体内の元の位置でiPS細胞をつくる方法で、再生医療を開発する試みがいくつか行なわれてきた。2014年、山中伸弥は眼科医の高橋政代との共同研究で、加齢黄班変成の患者の目にiPS細胞に由来する一種の網膜細胞を移植した。部分的な失明を引き起こすこの病気は、網膜感光性細胞の劣化によって生じる。幹細胞治療では、有望な領域のひとつだ。ヒト胚性幹細胞は、適切な条件下に置けば網膜細胞のなかで発達することが示されていて、マウスやラットを使った実験では、培養された手術で移植された細胞が光を検出し、反応して神経信号を出せることがわかっていた。大きな課題は、目のような繊細な器官に実際に手術を行なうことにある。
iPS細胞由来の細胞を注入する山中の試みでは、結果はまちまちだった。病気の進行は止まったようだが、患者の視力に改善は見られなかった。そして、患者のiPS細胞に気にかかる遺伝子変異が現れたので、二度めの試みを中止しなくてはならなかった。
日本の研究者たちは、iPS細胞を培養してつくったニューロンを使用して、神経変性を治療する方法も試験している。京都大学病院の脳神経外科医の菊池隆幸は、ドナー由来のiPS細胞で培養したニューロンの前駆細胞を、50代のパーキンソン病患者の脳に移植した。現在は既知の治療法がないこの病気は、運動に関連する神経伝達物質ドーパミンの放出を担うニューロンの死が原因で起こる。iPS細胞自体を直接脳に移植することで、ドーパミン病に似た病気にかかったマカクザルの症状を改善し、可動性が高まって、見たところ有害な副作用は何もないことが示されている。
臨床試験に使われたiPS細胞はドーパミンを産生できると見なされ、菊地のチームは、患者の脳内のドーパミン活性部位として知られるさまざまな場所に240万個の細胞を移植した。患者の経過は良好なようで、初期の結果は有望だと思われる。この状態が保たれるなら、いずれさらに多くの細胞を移植する計画を立てている。この治療法は、2023年ごろまでには一般に利用できるようになるだろうと菊池らは考えている。